- Accueil
- Actualités
- Quand La Lumière Rigidifie Les Cellules
Quand la lumière rigidifie les cellules
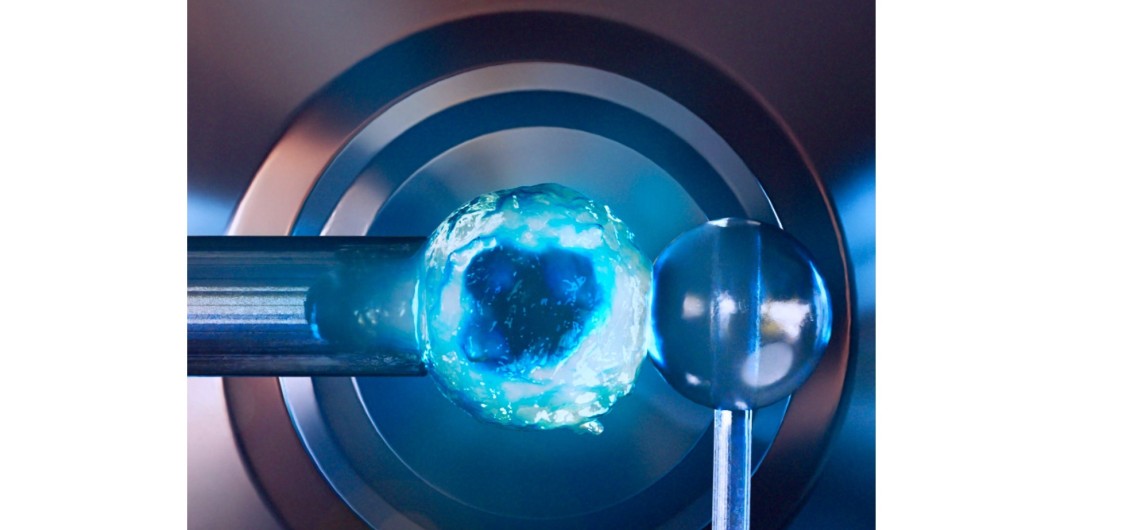 Un lymphocyte tenu par une micropipette est approché d’une bille située à l'extrémité d'une tige en verre afin de mesurer sa rigidité. Vue d’artiste d’une expérience réalisée au LadHyX. Image par Julien Husson (https://cellmechanics.jimdofree.com/)
Un lymphocyte tenu par une micropipette est approché d’une bille située à l'extrémité d'une tige en verre afin de mesurer sa rigidité. Vue d’artiste d’une expérience réalisée au LadHyX. Image par Julien Husson (https://cellmechanics.jimdofree.com/)
Lors d’une expérience au microscope destinée à observer le comportement de cellules immunitaires, Julien Husson et son équipe ont remarqué une chose inattendue : la cellule, un lymphocyte, semblait devenir inerte, comme durcie. Au cours de ces expériences, les scientifiques ajoutaient des molécules fluorescentes capables de se lier au calcium présent. Éclairées par la suite avec de la lumière bleue, ces molécules émettent un signal proportionnel à la quantité de calcium, permettant de mesurer ainsi l’activité cellulaire.
Phototoxicité et durcissement
Cette technique de microscopie par fluorescente est très utilisée en biologie et la toxicité induite par la lumière était connue, mais pas l’effet de durcissement. « Les scientifiques utilisant la microscopie par fluorescence ont connaissance de cette phototoxicité, et les protocoles d’observation la prennent en compte pour la minimiser. Mais l’établissement d’un lien entre cette phototoxicité et un changement de mécanique cellulaire n’avait pas été étudié en détail » explique Julien Husson, chercheur au Laboratoire d’hydrodynamique (LadHyX*), qui a cherché à en savoir plus avec au sein d’une collaboration**.
Dans les expériences qu’il conçoit au LadHyX, les propriétés mécaniques peuvent être mesurées à l’échelle des cellules grâce à des micropipettes. On aspire légèrement ainsi un lymphocyte à l’extrémité d’une micropipette, puis on vient l’appuyer contre une mince tige en verre. La flexion de la tige permet de mesurer la force ainsi appliquée et, en mesurant le déplacement de la micropipette, les scientifiques en déduisent de combien la cellule s’est déformée. Ils peuvent ensuite quantifier la rigidité de la cellule. En temps normal, un lymphocyte est très mou.
Lorsqu’on charge l’intérieur d’une cellule avec des molécules fluorescentes, la rigidité de la cellule ne change pas. En revanche, lorsqu’on illumine la cellule avec de la lumière, les choses changent radicalement, et parfois cellule devient jusqu’à dix fois plus rigide ! La cellule devient dure et perd sa capacité d’action. « Nous avons testé différentes molécules fluorescentes, différents types de cellules, des globules blancs aux cellules endothéliales : il y a toujours une rigidification comparée aux expériences faites sur des cellules témoins » poursuit Julien Husson.
Rôle des espèces réactives de l'oxygène
« Qu’est-ce qui produit cette rigidification ? Sans doute des espèces chimiques créées lorsque la lumière active la molécule fluorescente », avancent les auteurs. En effet, cet éclairement est corrélé à la production d’espèces chimiques réactives de l’oxygène, qui ont la capacité de créer des liaisons fortes (dites covalentes) avec les molécules autour d’elles. « Notre hypothèse est que ces liaisons sont responsables du durcissement cellulaire. Pour aller plus loin, il faudrait montrer localement la présence de liaisons covalentes lors de ce processus », détaille le chercheur.
Julien Husson voit des perspectives à ces travaux. Par exemple, une thérapie contre le cancer pourrait en bénéficier : la thérapie photodynamique. Elle consiste à injecter dans les cellules cancéreuses une molécule qui, éclairée par de la lumière, engendre la production d’espèces réactives qui causent la mort des tumeurs. La mesure de la rigidité pourrait aider à évaluer l’efficacité de cette méthode, et éventuellement à adapter les doses.
Référence de la publication :
Eva Gonzalez, Jana El Husseiny, Finn Bastian Molzahn, Tiffany Campion, Hadrien Jalaber, Stéphanie Dogniaux, Pierre-Henri Puech, Oliver Nüsse, Laure Gibot, Julien Husson, Stiffening cells with light, Cell Reports Physical Science, 2025, https://doi.org/10.1016/j.xcrp.2025.10299
*LadHyX : une unité mixte de recherche CNRS, École polytechnique, Institut Polytechnique de Paris, 91120 Palaiseau, France
**Laboratoire Adhésion et Inflammation, Aix Marseille Université UM61, CNRS UMR 7333, Inserm U1067, Marseille ; Laboratoire Softmat, Université de Toulouse, CNRS UMR 5623, Toulouse ; Institut de Chimie Physique, CNRS UMR 8000, Université Paris-Saclay, Orsay ; Analyse integrative de l'activation des lymphocytes T, Institut Curie-PSL Research University, INSERM U932, Paris
 Je soutiens l'X
Je soutiens l'X